酸は水に溶けると酸性、アルカリは水に溶けるとアルカリ性になる物質のことです。酸性の水溶液は水素イオン、アルカリ性の水溶液は水酸化物イオンが含まれています。酸性の水溶液とアルカリ性の水溶液を混ぜると中和がおこり、水溶液は中性に近づいていきます。
酸やアルカリにはいったいどんな物質が?酸性、アルカリ性の水溶液にはどのような性質が?リトマス紙を使った酸性・アルカリ性水溶液の実験ではどのような変化が起きるのでしょうか。
酸とアルカリを混ぜて水溶液を中和させると、イオンの数にどのように変化が起きるのか、酸とアルカリ、中和に関する基本事項を解説、酸とアルカリ、中和に関する問題も準備しました。酸・アルカリ、中和の理解を深めましょう!
酸とアルカリ
酸は水に溶けると酸性に、アルカリは水に溶けるとアルカリ性になる物質のことです。酸とアルカリはいずれも電解質です。
酸性とアルカリ性の水溶液
酸性とアルカリ性はpHで表すことができ、pHの値が7より小さいなら酸性、7より大きいならアルカリ性になります。
酸性の水溶液
(例)硫酸、硝酸、酢酸、塩酸、炭酸、レモン水
・pHが7より小さい(pH試験紙が赤色になる)
・青色リトマス紙を赤色になる
・緑色のBTB溶液が黄色になる
・マグネシウム、亜鉛などの金属と反応して水素を発生する
・すっぱい
間違えられやすいのですが、酸素は水に溶けにくく、酸性ではありません(酸素は中性)。二酸化炭素は水に溶かすと酸性です。
アルカリ性の水溶液
(例)アンモニア、水酸化ナトリウム、水酸化バリウム、水酸化カルシウム、石けん水、石灰水
・pHが7より大きい(pH試験紙が青色になる)
・赤色リトマス紙が青色になる
・緑色のBTB溶液が青色になる
・フェノールフタレイン溶液が赤色になる
フェノールフタレイン溶液以外は青色になるものが多いです。
酸の電離
酸は水溶液中で電離して水素イオン(H+)を生じます。
【酸の電離】
塩酸(塩化水素):HCl→H++Cl-
硫酸:H2SO4→2H++SO42-
硝酸:HNO3→H++NO3-
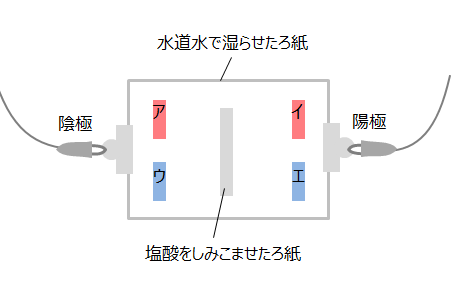
上の図のような装置(ア・イは赤色リトマス紙、ウ・エは青色リトマス紙)で電圧をかけると、水素イオンH+は陰極側に、塩化物イオンCl-は陽極側に移動します。そのため陰極側の青色リトマス紙が赤くなります。(色の変化が起きるリトマス紙はウのみです。)
アルカリの電離
アルカリは水溶液中で電離して水酸化物イオン(OH-)を生じます。
【アルカリの電離】
水酸化ナトリウム:NaOH→Na++OH-
水酸化バリウム:Ba(OH)2→Ba2++2OH-
水酸化カルシウム:Ca(OH)2→Ca2++2OH-
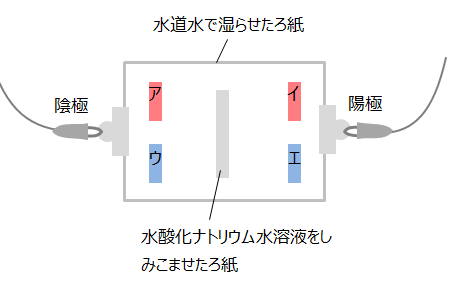
上の図のような装置(ア・イは赤色リトマス紙、ウ・エは青色リトマス紙)で電圧をかけると、水酸化物イオンOH-は陽極側に、ナトリウムイオンNa+は陽極側に移動します。そのため陽極側の赤色リトマス紙が青くなります。(色の変化が起きるリトマス紙はイのみです。)
中和
酸性の水溶液とアルカリ性の水溶液を混ぜたとき、お互いの性質を打ち消し合う反応のことを中和といいます。
酸性の水溶液にアルカリ性の水溶液を少しずつ加えると、酸性→中性→アルカリ性と水溶液が変化していきます。ここで水溶液が「酸性→中性」となる過程で中和が起きています。(中性になったときだけで中和が起きているというわけではありません。)
酸性の水溶液中の水素イオンとアルカリ性の水溶液中の水酸化物イオンが結びついて水ができ、酸性の水溶液中の陰イオンとアルカリ性の水溶液中の陽イオンが結びついて塩(えん)ができます。
【酸+アルカリ→水+塩】
塩酸と水酸化ナトリウム水溶液→水と塩化ナトリウム
HCl+NaOH→H2O+NaCl
硫酸と水酸化バリウム水溶液→水と硫酸バリウム
H2SO4+Ba(OH)2→H2O+BaSO4
中和反応「塩酸+水酸化ナトリウム水溶液」
塩酸の電離式:HCl→H++Cl-
水酸化ナトリウムの電離式:NaOH→Na++OH-
化学反応式:HCl+NaOH→H2O+NaCl
塩酸に水酸化ナトリウム水溶液を加えて中和させたときのイオン数の変化を、下表にまとめました。(水素イオンと塩化物イオンの数の比は1:1、水酸化物イオンとナトリウムイオンの数の比は1:1です。)
| 水素イオンH+ | 減っていき、中性になるとなくなる |
| 塩化物イオンCl- | 変化なし |
| 水酸化物イオンOH- | 中性になるまでは0、水素イオンがなくなると増えていく |
| ナトリウムイオンNa+ | 増えていく |
塩酸に水酸化ナトリウム水溶液を加えていくと、水溶液は酸性→中性→アルカリ性と変化していきます。
中和(H++OH-→H2Oの反応)が起きている間は、もともと水溶液中にあるH+はどんどん減り、OH-は水酸化ナトリウム水溶液を加えてもH+と結びつくため数が増えません。
水溶液が中性になると、つまりH+の数が0になってしまうとOH-は水酸化ナトリウム水溶液を加えるほど増えていきます。
Cl-はずっと変わらず、Na+は水酸化ナトリウム水溶液を加えている限り増え続けます。
中和反応「硫酸+水酸化バリウム水溶液」
硫酸の電離式:H2SO4→2H++SO42-
水酸化バリウムの電離式:Ba(OH)2→Ba2++2OH-
化学反応式:H2SO4+Ba(OH)2→H2O+BaSO4
硫酸バリウムBaSO4は水に溶けにくいため、白い沈殿ができます。
イオンの数の比は
水素イオンH+:硫酸イオンSO42-=2:1
水酸化物イオンOH-:バリウムイオンBa2+=2:1
硫酸に水酸化バリウム水溶液を加えて中和させたときのイオン数の変化を、下表にまとめました。
| 水素イオンH+ | SO42-の2倍量から減っていき、中性になるとなくなる |
| 硫酸イオンSO42- | 減っていき、中性になるとなくなる |
| 水酸化物イオンOH- | 中性になるまでは0、水素イオンがなくなると増えていく(Ba2+の2倍) |
| バリウムイオンBa2+ | 中性になるまでは0、水素イオンがなくなると増えていく |
硫酸に水酸化バリウム水溶液を加えていくと、水溶液は酸性→中性→アルカリ性と変化していきます。
H+はSO42-の2倍あります。中和(H++OH-→H2Oの反応)が起きている間は、もともと水溶液中にあるH+はどんどん減り、OH-は水酸化ナトリウム水溶液を加えてもH+と結びつくため数が増えません。
Ba2+はSO42-と結びついて硫酸バリウムBaSO4になります。(硫酸バリウムはイオンになりません。)水酸化バリウム水溶液を加えていくと、もともとあったSO42-は減少してやがてなくなります。Ba2+は水酸化バリウム水溶液を加えても最初は増えませんが、中性になったその後は増えていきます。
【問題編】酸とアルカリ、中和
問1 酸性の水溶液は何色のリトマス紙を何色に変化させるか。
答えを確認問2 pHが8のとき、酸性かアルカリ性か。
答えを確認問3 アルカリ性の水溶液はフェノールフタレイン溶液の色を何色にするか。
答えを確認問4 下の図のような装置で電圧をかけると、ア~エのどのリトマス紙が変化するか。
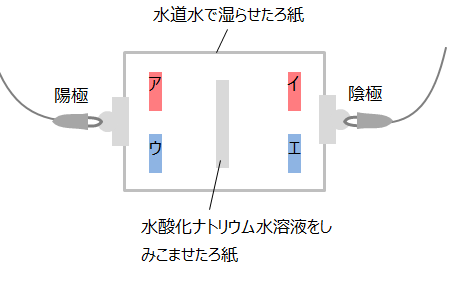
答えを確認
問5 問4でリトマス紙の色を変えたイオンは何というイオンか、イオン式で答えなさい。
答えを確認問6 硫酸に水酸化バリウム水溶液を混ぜたときにできる物質は何か。
答えを確認問7 問6の物質のように、酸の陰イオンとアルカリの陽イオンが結びついてできる物質を何というか。
答えを確認問8 問6のように、酸性の水溶液とアルカリ性の水溶液を混ぜたときに起きる化学変化を何というか。
答えを確認問9 BTB溶液を加えた塩酸に、水酸化ナトリウム水溶液を少しずつ加えていった。黄色だった溶液が緑色になり、青色に変化した。このとき水素イオン、水酸化物イオン、塩化物イオン、ナトリウムイオンの数はどのように変化するか。下のア~エのグラフから選びなさい。
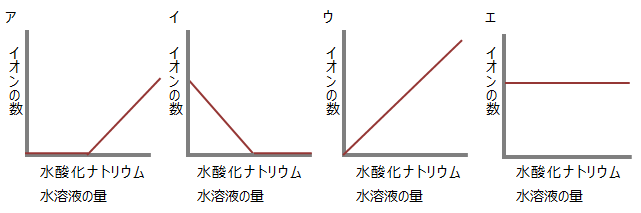
答えを確認
問10 BTB溶液を加えた塩酸12cm3に、さまざまな量の水酸化ナトリウム水溶液を加えたときの水溶液の色の変化を下の表にまとめた。エの水溶液を中性にするには、同じ濃度の塩酸を何cm3加えたら良いか。
| ア | イ | ウ | エ | |
| 水酸化ナトリウム水溶液の体積 | 5cm3 | 10cm3 | 15cm3 | 20cm3 |
| 水溶液の色 | 黄 | 黄 | 緑 | 青 |
まとめ
酸、アルカリ、中和について学習してきましたがいかがでしたでしょうか。
- 酸性、アルカリ性のそれぞれの特徴とは。
- リトマス紙やBTBなどでどのような色の変化が起きるのか。
- 酸とアルカリの電離式や、実験ではどのリトマス紙で色の変化が起きるのか。
- 中和の化学反応式とは。
- 酸性とアルカリ性の水溶液で中和させるとイオンの数にどのような変化が起きるのか。
まずは以上のことをしっかり押さえておきましょう。

