原子の構造とイオンに関するまとめと問題です。
原子は陽子と中性子からなる原子核と、電子でできています。陽子は+の電気、電子は-の電気を帯びていますが、原子は電気的に中性になります。+の電気や-の電気を帯びているのがイオンです。
原子の構造と陽子・中性子・電子の特徴、イオンのでき方、イオン式について見ていきます。
原子の構造~陽子・中性子・電子~
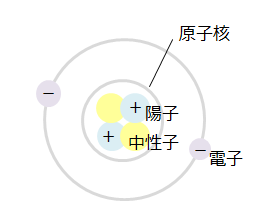
原子の構造を確認します。上の図はヘリウムの原子構造を模式的に表したものです。原子には陽子と中性子、電子という3つの粒子があり、原子によってそれらの数は異なっています。
原子核
原子核は陽子と中性子から構成されています。
陽子
原子核の中にある陽子は+の電気を持っている粒子です。
中性子
原子核の中にある中性子は電気を帯びていません。
中性子は電気を持たないですが、陽子を原子核の中で安定させる役割があります。+の電気を持つ陽子が多くなると陽子同士で反発しますが、それを中性子が抑えます。陽子が1つしかない水素(のほとんど)は中性子がありません。
電子
電子は原子核の外にあり、-の電気を帯びています。
陽子と電子の数
一つの原子にある陽子と電子の数は等しくなります。+の電気を帯びた陽子と-の電気を帯びた電子の数が等しいことで、原子全体では電気的に中性になっています。後で学習するイオンでは陽子と電子の数が等しくなっていません。
陽子と中性子の質量
陽子と中性子の質量はほぼ等しく、陽子と中性子の質量の合計が原子の質量数となります。電子の質量はそれらよりずっと小さいです。なお原子には「原子番号」というのがありますが、陽子の数と原子番号は等しくなります。
原子の構成
・原子核(陽子<+>と中性子)と電子<->でできている
・陽子の数=電子の数
・陽子の質量≒中性子の質量>>>電子の質量 (≒はほぼ等しいということ)
イオンのでき方
原子は電気的に中性ですが、イオンは+あるいは-の電気を帯びています。イオンには陽イオンと陰イオンがあります。
例えば水素が電子を失うと「水素イオン」といい、「H+」というイオン式で表されます。
水素の化学式⇒H2
水素イオンのイオン式⇒H+
水酸化物イオン(OH-)、硝酸イオン(NO3-)のように複数の原子からなるイオンを多原子イオンといいます。
陽イオンとイオン式一覧
原子が電子を失い、+の電気を帯びたものを陽イオンといいます。原子では水素や金属が陽イオンになります。
「+」だからといって電子が増えたわけではありません。
電子を1個失うと1価の陽イオン、2個失うと2価の陽イオン、3個失うと3価の陽イオンといいます。陽イオンは右上に+や2+などをつけて表します。数字は失った電子の数=価数を表しますが、価数が1のときは数字を書きません。
| 価数 | 主な陽イオンのイオン式 |
| 1価 | ●水素イオン(H+)
●ナトリウムイオン(Na+) ●銀イオン(Ag+) ●カリウムイオン(K+) ●アンモニウムイオン(NH4+) |
| 2価 | ●銅イオン(Cu2+)
●亜鉛イオン(Zn2+) ●カルシウムイオン(Ca2+) ● 鉄(II)イオン(Fe2+) |
| 3価 | ●アルミニウムイオン(Al3+)
● 鉄(III)イオン(Fe3+) |
陰イオンとイオン式一覧
原子が電子を受け取り、-の電気を帯びたものを陰イオンといいます。
電子を1個受け取ると1価の陰イオン、2個失うと2価の陰イオン、3個失うと3価の陰イオンといいます。陰イオンは右上に-や2-などをつけて表します。数字は受け取った電子の数=価数を表しますが、価数が1のときは数字を書きません。
| 価数 | 主な陰イオンのイオン式 |
| 1価 | ●塩化物イオン(Cl-)
●水酸化物イオン(OH-) ●硝酸イオン(NO3-) ●酢酸イオン(CH3COO-) |
| 2価 | ●硫化物イオン(S2−)
●硫酸イオン(SO42−) ●炭酸イオン(CO32−) |
※ Cl-(塩化物イオン)を塩素イオン、S2−(硫化物イオン)を硫黄イオンとしないよう注意しましょう。
【問題編】原子の構造・イオン
原子の構造とイオンのでき方の基本事項は覚えられたでしょうか?次の問題にチャレンジしてみましょう!(答えは▶をクリック)
問1 原子核を構成する2つの粒子を答えなさい。
問2 原子の中で陽子と質量がほぼ等しい粒子は?
問3 原子の中で陽子と数が等しくなる粒子は?
問4 原子の中で+の電気を帯びた粒子は?
問5 原子の中で電気を帯びていない粒子は?
問6 陽イオンに関するア~ウの記述から、正しいものを選びましょう。
ア 陽イオンは電子を受け取ってできたイオンである。
イ 陽イオンは電子を失ってできたイオンである。
ウ 陽イオンは陽子を受け取ってできたイオンである。
問7 陽イオンになりやすいのは金属原子か、非金属原子か。
問8 水素イオンのイオン式を書きなさい。
▶答え問9 イオン式Cl-の名称を答えましょう。
問10 アルミニウムイオンは( ア )価の( イ )イオンである。
問11 OH-、NO3-のように複数の原子からなるイオンを何といいますか。
▶答え問12 問11のイオンで、OH-、NO3-以外のイオン式を1つ答えなさい。
▶答えまとめ
- 原子の構成…原子核(陽子・中性子)と電子
- 陽子は+の電気、電子は-の電気、原子は電気的に中性。
- 原子が電子を失うと陽イオンになり、電子を受け取ると陰イオンになる。
- ○個の電子を失った陽イオンは○価の陽イオン、○個の電子を受け取った陰イオンは○価の陰イオン。

